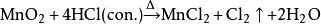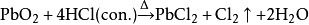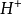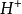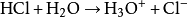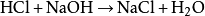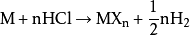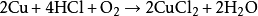是化学变化,判断是化舌哆猢筢学变化还是物理变化的根本区别是是否生成新物质。
石灰石即CaCO3与 盐酸HCL反应:CaCO3+2HC讣嘬铮篌L=CaCl2+H2O+CO2(g)
因此:是化学变化。
石灰石主要成分碳酸钙(CaCO3)。石灰和石灰石是大量用于建筑材料、工业的原料。石灰石可以直接加工成石料和烧制成生石灰。生石灰CaO吸潮或加水就成为熟石灰,熟石灰主要成分是Ca(OH)2,可以称之为氢氧化钙,熟石灰经调配成石灰浆、石灰膏等,用作涂装材料和砖瓦粘合剂。
盐酸(hydrochloric acid )是氯化氢(HCl)的水溶液 ,属于一元无机强酸,工业用途广泛。盐酸的性状为无色透明的液体,有强烈的刺鼻气味,具有较高的腐蚀性。
浓盐酸(质量分数约为37%)具有极强的挥发性,因此盛有浓盐酸的容器打开后氯化氢气体会挥发,与空气中的水蒸气结合产生盐酸小液滴,使瓶口上方出现酸雾。盐酸是胃酸的主要成分,它能够促进食物消化、抵御微生物感染。
扩展资料:
还原性
盐酸具有还原性,可以和一些强氧化剂反应,放出氯气:
二氧化锰:
二氧化铅:
一些有氧化性的碱和盐酸可以发生氧化还原反应,而不是简单的中和反应。
酸性
盐酸溶于碱液时与碱液发生中和反应。
盐酸是一种一元强酸,这意味着它只能电离出一个
。在水溶液中氯化氢分子完全电离,与一个水分子络合,成为H3O+,使得水溶液显酸性:
可以看出,电离后生成的阴离子是Cl-,所以盐酸可以用于制备氯化物,例如氯化钠。
盐酸可以与氢氧化钠酸碱中和,产生食盐:
稀盐酸能够溶解许多金属(金属活动性排在氢之前的),生成金属氯化物与氢气:
铜、银、金等活动性在氢之后的金属不能与稀盐酸反应,但铜在有空气存在时,可以缓慢溶解 ,例如:
参考资料: