1、计算:需要多少毫升质量分数为98%的1.84g/mL的浓硫酸例如:配蚩狠希搁备500ml的1mol/L的硫酸溶液方法:利用溶质物质的量不变的规律计算
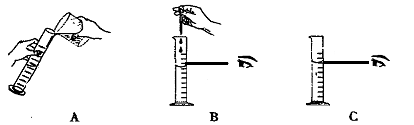
2、量取:A:将一定量浓硫酸倒入量筒中.B:接近所要的体积时,采用胶头滴管滴加。C:切记视线要与量筒内液体凹液面最低处水平。
3、稀释:(稀释浓硫酸时放热,搅拌防止局部积温导致液滴飞溅)往烧杯中放入两三百毫升的蒸馏水,一边搅拌,一边缓慢加入浓硫酸,搅拌至稀释完毕。
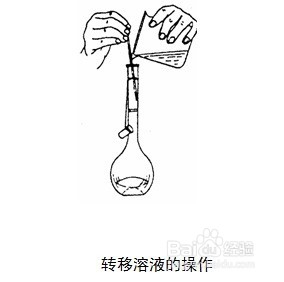
4、移液:(待烧杯内的溶液冷却后)玻璃棒下端抵住容量瓶刻度线以下的瓶壁上,缓缓将烧杯内的溶液转移入容量瓶。对烧杯及玻璃棒进行洗涤,并同样转入容量瓶中。
5、摇匀:手握住容量瓶瓶颈部分,旋转摇匀,注意不要使液面高过刻度线。
6、定容:玻璃棒下端抵住容量瓶刻度线以下的瓶壁上,向容量瓶粝简肯惧内加入蒸馏水,直至接近刻度线1~2cm。改用胶头滴管滴加蒸馏水,视线与凹液面最低处水平,直至最低处到达刻度线处为止。
7、摇匀:盖好玻璃瓶塞,右手抵住玻璃瓶塞,左手拖住容量瓶底,上下颠倒,摇匀。
8、装瓶:将配制好的溶液装入细口瓶中,贴好标签,并保存。